- 发布时间:2008-11-22 16:41:00
- 发布者:吾爱
- 微信号:wuaiyazhu.
- 浏览量:
- Tags:
-
 公告:
公告:
“酸与碱之间会发生什么反应”教学设计

方案三:
学生6:化学反应中通常伴随有能量的变化。可用温度计分别测定反应前后的温度变化,来证明化学反应的发生。不过,用量太少,反应放热太少,温度计测不到温度的改变,我们组选择20mLHCl(1:2)溶液和20ml 5%NaOH溶液混合,可测到温度大约升高了8℃;选择20mL HCl(1:1)溶液和20mL 10%NaOH溶液混合,可测到温度升高了约16℃。
(由学生6讲解,学生7动手演示实验)
教师:能利用化学反应能量的变化来证明,很有创新。酸碱中和反应都会放出热量。溶液的用量不同、溶液的质量分数不同所放出的热量就会不同。
[教师小结]同学们设计的实验方案都能成功地证明NaOH溶液与HCl溶液发生了中和反应。当某一化学反应无明显现象时,我们可考虑从其它方面来检验化学反应是否发生。
[教师演示实验]向Ba(OH)2溶液滴加H2SO4溶液,观察溶液导电能力的变化。
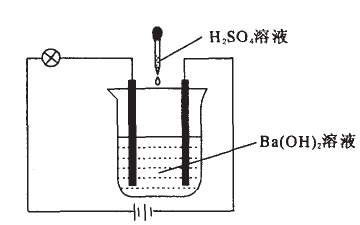
[学生描述实验现象]烧杯中有白色沉淀生成,灯泡的亮度先变暗后变亮。
[教师引导]为什么会出现这些现象呢?
[学生讨论,得出结论]Ba(OH)2溶液在水中解离出Ba2+和OH-,H2SO4溶液在水中解离出H+和SO42-,两者混合后OH-和H+结合成H2O,Ba2+和SO42-结合成沉淀,溶液中可自由移动的离子不断减少,溶液的导电性减小,当酸碱恰好中和时,溶液的导电性为0,灯泡熄灭,再继续滴加H2SO4溶液,使溶液中自由移动的离子浓度增加,导电性增强,灯泡又发光。化学方程式为H2SO4+Ba(OH)2 ==BaSO4↓+2H2O。
[教师小结]同学们理解得很透彻。下面我们用坐标图来显示H2SO4与Ba(OH)2酸碱中和对溶液导电性造成的变化。
(Flash动画演示:溶液导电性随滴加硫酸质量的增加而变化的曲线图)
[教师引导]事实上,酸碱中和反应在日常生活和工农业生产中有着广泛的应用。你能解释以下应用的原理吗?
①在酸性土壤中加入熟石灰;
②硫酸厂的污水中含有硫酸等杂质,可用熟石灰进行中和处理;
③胃酸过多的病人,可服用含氢氧化铝的药物中和过多的胃酸;
④被蚊虫叮咬后,可涂一些含碱性的物质(如肥皂水)的药水,可减轻痛痒。
[学生讨论]酸碱中和的实质是H++OH-→H2O,所以以上应用均可用此解释。
[教师小结]通过本节课的学习,你有哪些收获?……
[课后拓展]上网收集有关中和反应在生活中应用的资料。
5教学反思
新课程改变了传统的以“教材为中心”、“教师为中心”的教学模式,力求创设生动、真实、多样的科学探究和实践活动情境,让学生体验探究过程,在丰富多彩的活动中培养学生的创新精神和实践能力。通过本次探究活动,充分发挥了学生的主体作用,学生一致认为效果很好。不仅学到了知识,还学到了发现问题、分析问题、解决问题的科学探究方法。
在教学过程中,有意识地渗透化学与物理、数学的联系,突出各学科间知识的综合运用,培养了学生的综合处理问题的能力。在探究活动结束后,马上将中和反应的理论知识与实际应用紧密地联系起来,走入现实生产、生活,挖掘中和反应在日常生活和工农业产生中的广泛应用,真正让学生感受到了化学知识与我们的生活息息相关,认识到化学在促进社会可持续发展中的重要责任,从而培养了学生在生活中能主动关注与化学有关的社会问题的良好意识。