- 发布时间:2008-11-24 08:09:00
- 发布者:吾爱
- 微信号:wuaiyazhu.
- 浏览量:
- Tags:
-
 公告:
公告:
沪教版第二章 性质活泼的氧气 教案

学习任务
1.了解氧气和物理性质,掌握氧气的化学性质,初步了解氧化反应的概念。
2.学会观察叙述并记录有关化学实验的现象,并得出有关结论。会写出有氧气参与的几个
重要化学变化的文字表达式。
3.知道氧气的重要用途。
4.掌握实验室制取氧气的反应原理,仪器装置,收集方法,检验及操作注意事项,了解工
业上制氧气的方法和原理。
引言:人类的生命、生产、生活消耗氧气,为何空气中的氧气含量几乎不变。
原来绿色植物的光合作用是空气中氧气的主要来源,所以称绿色植物丰富的地区为氧吧。
讲解:氧气的工业制法,数轴的运用,
[信息传送]
常用气体钢瓶简介:
除装毒气的钢瓶外,钢瓶的一般工作压力都在
[板书]一、氧气的工业制法——分离液态空气
学生思考:
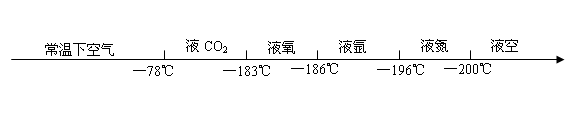
1、 一定大气压下,物质从液体变成气体时的温度叫什么?气体变成液体时的温度叫什么?
2、 常温下空气 — —183℃ — — — 液空 液氮 液氩 液氧 液CO2
已知下列物质在一个标准大气压下的沸点分别是:氮气:—
3、 分离液态空气制氧气过程中是否有新物质产生?属于什么变化?
二、氧气的实验室制法(之一)
药品:高锰酸钾,紫黑色固体
原理:给含氧元素的化合物加热制氧气,并收集
学生思考:
1、 高锰酸钾是固体,而氧气是气体,给固体加热制气体选择什么形状的装置,加热前该做什么?药品如何放置?如何加热?因药品可能潮湿,加热时管口应略向下倾斜,管内的导气管能否过长?刚刚冒出的气体中含有原容器中的空气,不能收集,为保证收集到更纯净的氧气,要注意①要等气泡连续均匀放出时方可收集②集气瓶中必须装满水,不留气泡(用纯氧气换出瓶中的水——气赶水)
2、 有关操作:给固定在铁架台上的试管均匀加热:点燃酒精灯,在试管下方来回移动数次,再将外焰对准药品加热。并缓慢地向试管底方向移动。
3、 使集气瓶里充满水,而不留有空气的操作:装满水,用玻璃片磨砂的一面盖住瓶口一部分,然后平推将瓶口盖住。
4、 验满:排水法:气泡从瓶口外的水槽中冒出
向上排空气法:带火星的木条放在瓶口,木条复燃则满。
5.停止加热时,要先把导气管移出水面,然后熄灭酒精灯,以防止水倒流而使试管炸裂。
6.制氧的固体反应物,不能混入易燃的杂质,如炭粉,纸屑及其他有机物等,以免发生爆炸。
7.管口附近放棉花的目的:防止加热时高锰酸钾粉末进入导管。
课堂小结:回顾本次课的内容,想一想学到了什么?
总结:检、装、固、加热、收、取、熄、整理
板书设计:第三节氧气的制法
一、 氧气的工业制法——分离液态空气
原理:利用液氮和液的氧的沸点不同,先降后升,逐个分离,属物理变化
二、氧气的实验室制法(之一)
1.药品:高锰酸钾,紫黑色固体
2.原理:给含氧元素的化合物加热制氧气,并收集
3.步骤:
4.注意事项:管口方向;管内导管;棉花;收集时间;结束后的处理。
5.有关操作:
6.收集和验满法:①排水法:氧气不易溶于水(收集到更纯净的氧气)
②向上排空气法:氧气的密度比空气大
7.反应式和反应类型:高锰酸钾![]()
8.分解反应